34º Entrega
Prescripción adecuada de antibióticos en pacientes críticos.
Responde:

M Cecilia Gonzalez. Médica Especialista en Terapia Intensiva.
Servicio de Terapia Intensiva. Sanatorio Parque.
Carlos Lovesio Médico Especialista en Terapia Intensiva.
Servicio de Terapia Intensiva. Sanatorio Parque.
Introducción
La sepsis es una de las principales causas de ingreso en terapia intensiva. Durante las últimas décadas se han logrado importantes avances en cuanto a su fisiopatogenia, diagnóstico, monitoreo y tratamiento; sin embargo las tasas de mortalidad persisten elevadas 1 . Los factores que influyen en este aspecto pueden ser propios del huésped o de la terapéutica instaurada. La utilización precoz y adecuada de los antibióticos es sin lugar a dudas uno de los pilares fundamentales en su tratamiento 2 . A pesar de la abundante información disponible, los cambios farmacocinéticos que se desarrollan en este grupo de pacientes son en muchas ocasiones impredecibles y constituyen un desafío para el médico intensivista 3 .
Si bien existen alteraciones en todos los procesos farmacocinéticos, los principales cambios suceden en el volumen de distribución de las drogas y en la depuración plasmática de las mismas. (3,4) A continuación se describirán brevemente estos fenómenos.
Absorción
En cuanto a la vía de administración de los antibióticos, la única vía pasible de utilización en la población de terapia intensiva es la endovenosa, ya que la biodisponibilidad de las drogas a través de la vía enteral varía enormemente por la utilización de vasopresores, el retardo en el vaciamiento y las alteraciones en la motilidad gástrica. Dado que el tratamiento antibiótico adecuado es indispensable para la sobrevida, la vía intravenosa es la única recomendada para los pacientes críticos. (3,4)
Distribución
La hidrofilicidad y lipofilicidad de la drogas influyen en su volumen de distribución. Así, las drogas hidrófilas como los betalactámicos, aminoglucósidos, linezolid o colistin, tienen volúmenes de distribución más pequeños y se distribuyen principalmente en compartimiento extracelular; en cambio las drogas lipofílicas como los macrólidos, tigeciclina o fluoroquinolonas tienen extensos volúmenes de distribución y debido a su desplazamiento al intracelular 3 . Por ello, las mismas presentan un aumento en la distribución en pacientes con un alto porcentaje de grasa corporal total.
Otro factor central que influye en este aspecto es la hipoalbuminemia, que constituye además una situación altamente frecuente en los pacientes críticos (3,4) . Las consecuencias se deben a que, según el porcentaje de unión de la droga a proteínas plasmáticas, la hipoalbuminemia produce un descenso en el porcentaje libre de las drogas, lo que altera el volumen de distribución 5 . Por otro lado, la fracción del fármaco no unida a proteínas es en general la que interviene en el clearence renal o hepático de las mismas, por lo que las variaciones en la unión a proteínas plasmáticas podrían llevar a modificaciones en la vida media de los fármacos. (6-7-8)
A su vez, el daño endotelial de los estados de respuesta inflamatoria sistémica, el aumento en la permeabilidad vascular y el pasaje de fluidos del intra al extravascular aumentan el volumen de distribución de las drogas hidrofílicas por aumento del espacio instersticial. De hecho, se han correlacionado scores de Apache II elevados con aumentos en el volumen de distribución (9-10) . También, la presencia de ventilación mecánica, circuitos extracorpóreos y drenajes quirúrgicos podrían contribuir a su incremento 3 .
Por fin, en los estados de shock e hipoperfusión tisular la distribución de antibióticos en tejidos periféricos podría disminuir considerablemente 5 y alterar la concentración del antimicrobiano en el sitio de acción. (Figura 1)

VMC: Volumen minuto cardíaco; Cl: Clearence; VD: Volumen de distribución
Fig. 1- Cambios fisiopatológicos durante la sepsis e influencia sobre la concentración plasmática de drogas.
Metabolismo La hidrofilicidad y lipofilicidad de las drogas influyen en el clearence de las mismas. Así, las drogas hidrófilas como los betalactámicos, aminoglucósidos, linezolid o colistin se eliminan principalmente por vía renal; en cambio las lipófilas como los macrólidos, tigeciclina o fluoroquinolonas se eliminan por metabolismo hepático. La falla hepática debe ser evaluada siempre en los pacientes críticos, aunque sea en forma cualitativa. Cuando las dudas acerca del metabolismo o eliminación hepáticas son importantes, es prudente rotar el esquema antibiótico utilizado. 3
Eliminación
Otro aspecto que puede experimentar grandes variaciones en cuanto a la farmacocinética de los pacientes críticos es la eliminación o clearence de las drogas. Tanto situaciones de insuficiencia de órganos de eliminación, como pueden ser la falla renal o hepática, como situaciones de aumento en la función de los mismos pueden generar repercusiones drásticas en la vida media de los fármacos y condicionar fallas en el tratamiento o efectos tóxicos.
La falla renal es una afección frecuente en la población de terapia intensiva, y motiva frecuentemente correcciones en la dosificación de fármacos de eliminación renal. Debemos recordar, que las fórmulas para estimar filtrado glomerular, como la de Crockoft Gault y MDRD, han sido diseñadas y validadas para pacientes renales crónicos ambulatorios y no en pacientes críticos. Por lo tanto, su uso no es aconsejado en terapia intensiva. La única manera confiable de definir la tasa de filtración glomerular renal es la recolección de orina y medición de la depuración plasmática de creatinina. El clearence de inulina o de iothalamato si bien constituyen el "gold standard" para la medición, son dificultosos y no pueden realizarse al borde de la cama del paciente.
En la terapia de reemplazo renal la falla en lograr dosificaciones adecuadas puede generar dosis tóxicas de los fármacos, o por el contrario, desarrollo de resistencia microbiana y fracaso en el tratamiento. Los efectos sobre los niveles séricos de antibióticos son variables, por ejemplo, las drogas hidrofílicas tienen un mayor porcentaje del fármaco en el intravascular y por ello tienen mayor probabilidad de ser eliminadas a través de la diálisis. Por otro lado, las drogas con importante unión a proteínas plasmáticas presentan sólo un pequeño porcentaje de eliminación a través de la diálisis que es proporcional a la fracción libre presente en plasma. Además, la variabilidad en los niveles plasmáticos de antibióticos de los pacientes críticos por alteraciones en el volumen de distribución, en las proteínas plasmáticas y en el metabolismo hacen que al adicionar la terapia de reemplazo renal, las concentraciones plasmáticas se vuelvan impredecibles (9,11,16) .
Se han propuesto diferentes formas para ajustar la prescripción antibiótica. En primer lugar se debe conocer el peso molecular de la sustancia para evaluar si atraviesa la membrana dialítica, aunque con las membranas utilizadas en la actualidad este dejó de ser un aspecto relevante. Por otro lado, el régimen terapéutico adecuado debería contemplar el cálculo del volumen de distribución para determinar la dosis de carga, y el clearence total de la sustancia con el objetivo de determinar el intervalo entre las dosis. Este último debería incluir la eliminación a través de la técnica dialítica y la eliminada a través de metabolismo hepático o eliminación renal en los pacientes que conserven diuresis residual. La eliminación a través a de la membrana dialítica se puede estimar según el coeficiente de sieving , que establece que las sustancias con un coeficiente de uno no filtran a través de la membrana y los cercanos a cero filtran completamente. Finalmente, debemos conocer el mecanismo de acción del antibiótico a estudiar, si la acción bactericida es concentración dependiente o tiempo dependiente. Si es tiempo dependiente sería útil administrar el fármaco por infusión continua, para asegurar el mayor porcentaje del tiempo posible por encima de la concentración inhibitoria mínima, y el ritmo de la infusión debería igualar al clearence del mismo. Si el antibiótico es concentración dependiente, debemos asegurar que alcance una adecuada relación entre concentración máxima y el área bajo la curva (9,11) .
Algunas recomendaciones durante la terapia de reemplazo renal continua son de 20 a 35 mg/k de vancomicina como dosis de carga seguida de 14/mg/kg/día por infusión continua, 12 cefepime 2 gr cada 12 hs, 13 y uso de dosis para pacientes sin falla renal para el colistin 14 . Por el contrario, se necesitan dosis mayores de fluconazol (400 mg cada 12 hs) por la ausencia de reabsorción tubular del mismo 15 . Respecto a los aminoglucósidos y betalactámicos se ha sugerido utilizar dosis altas al inicio del tratamiento, que luego podrían ajustarse según la falla renal y hepática 9 .
Sin embargo, ninguno de los esquemas terapéuticos propuestos para ajustar la dosificación en terapia de reemplazo renal cuenta con el aval de evidencia suficiente para establecer una recomendación clara tanto por el diseño de los estudios como por las dificultades en extrapolar los resultados a todos los pacientes críticos. Debemos recordar, que estas propuestas constituyen simplemente aproximaciones a una problemática muy compleja, que sin lugar a dudas obliga a la monitorización plasmática y vigilancia continua de los antibióticos utilizados. Lamentablemente, en la práctica diaria sólo se encuentra disponible para pocos antibióticos; situación que debería modificarse en el futuro por la clara necesidad de monitoreo en la población de pacientes críticos.
Por el contrario, situaciones de aumento en la función de los órganos de eliminación, como el riñón hiperfiltrante, pueden llevar a disminuir la vida media de los fármacos por aumento en su eliminación.
El riñón hiperfiltrante o el filtrado glomerular renal aumentado es un fenómeno clínico que se caracteriza por la presencia de filtrado glomerular renal por encima de los límites considerados normales (16-17-18) . La definición del fenómeno ha sido problemática ya que es controversial el punto de corte a partir del cual se reconoce su presencia. En general, se utilizan límites arbitrarios por encima de los cuales se define al riñón hiperfiltrante. Si bien no existe consenso en la comunidad médica sobre el punto de corte, se puede tomar 120 ml/min/m2 en mujeres y 130ml/min/m2 en hombres. (17-18)
La incidencia de riñón hiperfiltrante varía según la población estudiada, puede variar desde un 30% en poblaciones de terapia intensiva mixta, hasta un 85% en unidades de cuidados neurocríticos (20-21-22) . Los principales factores asociados en forma independiente a esta condición son la edad (pacientes jóvenes) y el trauma (22-23-24) .
Su principal importancia radica en la posibilidad de exponer al paciente a dosis subterapéuticas de antibióticos y conducir a fracaso en el tratamiento o aumento en la mortalidad. Por lo tanto, constituye una situación que debe diagnosticarse precozmente, y ante la cuál sería prudente realizar ajustes en la dosificación (17-18-19)
Por último, se ha observado recientemente que en pacientes con falla renal aguda pueden presentar niveles plasmáticos más bajos que los egresados por el clearence debido a que en estas circunstancias podría aumentar la degradación extrarenal. (Figura 2)
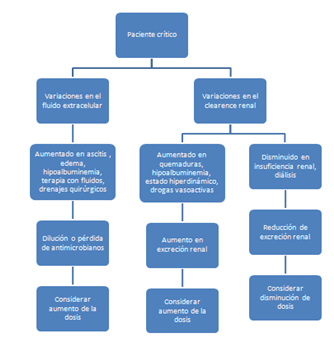
Fig 2.- Condiciones fisiopatológicas o iatrogénicas que afectan la distribución y eliminación de los antimicrobianos
Conclusión
Los pacientes críticos presentan numerosas alteraciones que producen cambios en la farmacocinética de las drogas. Esto lleva a que los esquemas terapéuticos habituales sean inapropiados y condicionen fallas en el tratamiento. El surgimiento de cepas microbiológicas multirresistentes alerta a la comunidad médica sobre la necesidad de realizar cambios en los esquemas de dosificación. La comprensión de esos cambios farmacocinéticos se vuelve central en esta tarea y el monitoreo plasmático de las drogas es fundamental e ineludible si se desean alcanzar buenos resultados.
Bibliografía
1. Vincent JL, Abraham E. The Last 100 Years of Sepsis. Am J Respir Crit Care Med 2006; 173: 256-263
2. Dellinger RP , Levy MM , Rhodes A , Annane D et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med 2013; 39:165-228
3. Roberts JA, Lipman J. Pharmacokinetic issues for antibiotics in the critically ill patient. Crit Care Med 2009; 37:3
4. Roberts JA et al. How to optimise antimicrobial prescriptions in the Intensive Care Unit: principles of individualised dosing using pharmacokinetics and pharmacodynamics. International Journal of Antimicrobial Agents 2012; 39: 187- 192
5. Smith BS, Yogaratnam D, Levasseur Franklin KE. Introduction to Drug Pharmacokinetics in the Critically Ill Patient. Chest 2012;141:1327-36
6. Hassan E, Ober JD. Predicted and measured aminoglycoside pharmacokinetic parameters in critically ill patients. Antimicrob Agents Chemother 1987;31:1855-58
7. Ulldemolins M, Roberts JA, Wallis SC, Rello J, Lipman J. Flucloxacillin dosing in critically ill patients with hypoalbuminaemia: special emphasis on unbound pharmacokinetics. J Antimicrob Chemother 2010;65:1771-8
8. Mimoz O, Soreda S, Padoin C, Tod M, Petitjean O, Benhamou D. Ceftriaxone pharmacokinetics during iatrogenic hydroxyethyl starch-induced hypoalbuminemia: a model to explore the effects of decreased protein binding capacity on highly bound drugs. Anesthesiology 2000;93:735-43
9. Udy AA, Roberts JA, Lipman J. Clinical implications of antibiotic pharmacokinetic principles in the critically ill. Intensive Care Med 2013; 39:2070-82
10. Kees MG, Vogeler S, Hilpert JW. Initial dosing of vancomycin in critically ill patients. Int J Antimicrob Agents 2011; 38:91-92
11. Earnest A. Antibiotic dosing and concentration variability during continuous renal replacement therapy: Is status quo good enough? Critical Care Med 2012; 40(5):1671-72
12. Beumier M, Roberts JA, Kabtouri H et al. A new regimen for continuous infusion of vancomycin during continuous renal replacement therapy. J Antimicrob Chemother 2013; doi:10.1093/jac/dkt261
13. Wilson FP, Bachhuber MA, Caroff D et al. Low cefepime concentrations during high blood and dialysate flow continuous venovenous hemodialysis. Antimicrob Agents Chemother 2012; 56:2178-80
14. Karvanen M, Plachouras D, Friberg LE et al. Colistin methanesulfonate and colistin pharmacokinetics in critically ill patients receiving continuous venovenous hemodiafiltration. Antimicrob Agents Chemother 2013; 57:668-671
15. Patel K, Roberts JA, Lipman J, Tett SE, et al. Population pharmacokinetics of fluconazole in critically ill patients receiving continuous venovenous hemodiafiltration: using Monte Carlo simulations to predict doses for specified pharmacodynamic targets. Antimicrob Agents Chemother 2011; 55:5868-73
16. Roberts DM, Roberts JA, Roberts MS. More Variability of antibiotic concentrations in critically ill patients receiving continuous renal replacement therapy: A multicentre pharmacokinetic study Critical Care Med 2012; 40(5):1523-28 17. Udy AA, Roberts JA, Lipman J. Augmented Renal Clearance: Unraveling the Mystery of Elevated Antibiotic Clearance. In: Vincent JL (ed). Yearbook of Intensive Care and Emergency Medicine. Springer, 2010, p 493-06
18. Conil JM, Georges B, Fourcade O et al. Assessment of renal function in clinical practice at the bedside of burn patients. Br J Clin Pharmacol 2007; 63: 583-94
19. Udy AA, Roberts JA, Boots RJ, Paterson DJ, Lipman J. Augmented Renal Clearance. Implications for Antibacterial Dosing in the Critically Ill. Clin Pharmacokinet 2010; 49: 1-16
20. Grootaert V, Willems L, Debaveye Y, Meyfroidt G, Spriet I. Augmented renal clearance in the critically ill: how to assess kidney function. Ann Pharmacother 2012; 46:952-959
21. Minville V, Asehnoune K, Ruiz S, Breden A, Georges B, Seguin T, Tack I, Jaafar A, Saivin S, Fourcade O, Samii K, Conil JM. Increased creatinine clearance in polytrauma patients with normal serum creatinine: a retrospective observational study. Crit Care 2011;15:R49
22. Riñón hiperfiltrante en el paciente crítico: Incidencia y factores asociados a su desarrollo. Campassi ML, Gonzalez MC, Dubin A et al. Medicina Intensiva 2012; 29: 43.
23. Claus BO, Hoste EA, Colpaert K, Robays H, Decruyenaere J, De Waele JJ. Augmented renal clearance is a common finding with worse clinical outcome in critically ill patients receiving antimicrobial therapy. J Crit Care in press
24. Udy AA, Roberts JA, Shorr AF, Boots RJ, Lipman J. Augmented renal clearance in septic and traumatized patients with normal plasma creatinine concentrations: identifying at-risk patients. Crit Care 2013;17:R35
|