Discusión del caso clínico. | Presentación |
Como objetivos para la discusión de este caso me propongo analizar las principales causas de pancitopenia en nuestro paciente, establecer una asociación entre imatinib y pancitopenia, establecer los motivos de falta de respuesta terapéutica de la leucemia mieloide crónica en nuestro paciente y realizar algunas consideraciones finales.
Estamos ante un paciente varón de 44 años, con antecedente de leucemia mieloide crónica (LMC) quien realiza tratamiento con imatinib con respuesta parcial al mismo y que, actualmente, se encuentra pancitopénico.
Como dato guía para la discusión de este caso me voy a central en este último hallazgo.
Podemos clasificar la pancitopenia según el sitio de origen en centrales o periféricas. En la siguiente tabla se muestran las múltiples causas de pancitopenia (TABLA 1).
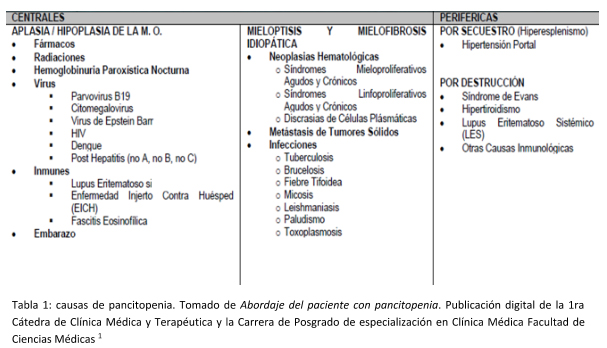
Quedan descartadas las radiaciones como causa, ya que nuestro paciente no presenta antecedentes laborales ni antecedente de exposición a las mismas, descarto inicialmente hemoglobinuria paroxística nocturna ya que no presenta clínica ni hallazgos de laboratorio que me hagan sospechar de la misma. Durante la internación se realizaron serologías para Virus de hepatitis B y C, HIV, Citomegalovirus, Parvovirus B19 y Virus de Epstein Barr que fueron negativas, alejando el diagnóstico de causas virales. Además, se realizó un laboratorio inmunológico que no presentó hallazgos de jerarquía, por ese motivo descarto inicialmente causas autoinmunes de pancitopenia. No presenta antecedentes de neoplasias sólidas ni hallazgos físicos o analíticos para sospecharlas, al igual que infecciones. En cuando a las causas de pancitopenia periférica, ya sea por secuestro o por destrucción, no presenta hallazgos clínicos ni imagenológicos de hiperesplenismo ni a nivel de laboratorio se evidencian hallazgos de destrucción celular como hiperbilirrubinemia, lactato deshidrogenasa elevada e hiperuricemia.
Una vez descartadas estas patologías voy a central mi discusión en las causas que creo más probables. Teniendo en cuenta los antecedentes de nuestro paciente y la medicación que recibía voy a enfocarme en causas farmacológicas y oncohematológicas.
Entre las neoplasias hematológicas se debe hacer referencia a la mielo fibrosis. Es una patología que se caracteriza por depósito de colágeno en la medula ósea asociado a una hematopoyesis extra medular. Dependiendo de si existe alguna patología o una noxa asociada podemos clasificarlas en primarias o idiopáticas y secundarias. Dentro de las secundarias existen múltiples causas, entre ellas trastornos inmunitarios, toxinas, enfermedades infecciosas, hematológicas y neoplasias malignas, en particular la leucemia mieloide crónica, patología que presenta nuestro paciente. En cuanto al diagnóstico de ésta patología, a nivel del laboratorio podemos evidenciar la presencia de anemia severa con leucocitos y plaquetas normales o pancitopenia, como en el caso de nuestro paciente. En frotis de sangre periférica vamos a evidenciar hallazgos característicos como glóbulos rojos en forma de lágrimas (dacriocitos) asociado a una reacción característica de leucoeritroblastosis donde se visualiza la presencia de precursores nucleados y células mieloides inmaduras. En la punción aspirativa de médula ósea vamos a encontrar una médula “seca” en la cual se visualiza fibrosis medular.
Si bien nuestro paciente se presenta con pancitopenia a nivel del laboratorio, los hallazgos en el frotis de sangre periférica no presentan ninguna de las características descriptas, por lo cual creo esta es una entidad poco probable.
La leucemia mieloide crónica, que presenta nuestro paciente, se caracteriza por un desorden clonal de las stem cell o células madres hematopoyéticas marcado por una translocación entre el cromosoma 9 y el cromosoma 22, dando como resultado la formación del cromosoma Filadelfia. Se genera además la formación del oncogén BRC/ABL que tiene la capacidad de estimular a la tirocinkinasa estimulando la proliferación celular e inhibiendo la apoptosis. Tiene una incidencia de 1.5 casos cada 100.000 habitantes con una presentación más frecuente ente los 30 y 50 años siendo el sexo masculino más frecuente (relación 1.3:1).
La historia natural de la leucemia mieloide crónica se caracteriza por tener una evolución bifásica (60%) o trifásica (40%) siendo en el 90% de los casos el diagnóstico durante la fase crónica o inicial de la enfermedad, como en el caso de nuestro paciente. Clínicamente se caracteriza por cursar de forma asintomática o con sintomatología inespecífica como sudoración nocturna, astenia, decaimiento del estado general o como en este caso, con pérdida de peso y dolor abdominal, siendo un hallazgo característico al examen físico la esplenomegalia. Entre los hallazgos característicos en sangre periférica vamos a evidenciar la presencia de leucocitosis con células inmaduras. Las plaquetas pueden estar en un valor normal o encontrarse aumentadas, asociado a una lactato deshidrogenasa aumentada. En el caso de nuestro paciente el diagnóstico se realizó con la presencia de 309.000 glóbulos blancos y la visualización de células inmaduras. Al realizar una biopsia de médula ósea el hallazgo característico es la presencia de una hipercelularidad, disminución del tejido adiposo y la presencia de hiperplasia de células leucopoyéticas, células inmaduras y blastos.
Es la etapa que fácilmente se controla con la medicación; si bien existen múltiples esquemas terapéuticos actualmente, uno de los fármacos más utilizados son los inhibidores de la tirocinkinasa, entre ellos el imatinib.
El imatinib es un inhibidor selectivo de la tirocinkinasa de primera generación, actualmente muy utilizado, que presenta un 75% de respuesta favorable en el tratamiento de la leucemia mieloide crónica. Fisiopatológicamente el gen BCR/ABL se une a la molécula de adenocintrifosfato provocando la fosforilación de distintos sustratos y, como consecuencia, activación de distintas vías de señalización. El imatinib bloquea la unión del gen BCR/ABL a la molécula de adenocintrifosfato y de esa manera inhibe la fosforilación de sustrato y la activación de las distintas vías de señalización.
En cuando a la respuesta terapéutica que puede generar tenemos 3 tipos:
- Hematológica la cual puede ser completa como en el caso de nuestro paciente, cuando no presenta signos ni síntomas de LMC, glóbulos blancos menores a 10.000, basófilos menores a 5 %, plaquetas normales, sin células inmaduras ni blastos y sin esplenomegalia. Parcial cuando presenta recuento leucocitario normal pero se evidencian células inmaduras, trombocitosis o persistencia de la esplenomegalia; o nula, cuando no presenta ninguno de los requisitos previos.
- Citogénica: realizando el dosaje del cromosoma Filadelfia y dependiendo del valor que presente puede ser completa (0% células Ph+), parcial (1-35% células Ph+), menor (36-65% células Ph+), mínima (66-95% células Ph+) o nula (96 - 100% células Ph+).
- Molecular según el valor logarítmico del gen BCR/ABL siendo completa (>3 log), parcial (2-3 log), mínima (1-2 log) o nula (<1 log).
En el caso de nuestro paciente, posterior al inicio del tratamiento había logrado una remisión hematológica completa de su enfermedad. Analizando la respuesta citogénica vemos que en Noviembre del 2018 presentaba una respuesta parcial al tratamiento (cromosoma Filadelfia de 22%) y posteriormente en Abril del 2019 progreso a una respuesta mínima (cromosoma Filadelfia de 49%), lo que nos hace sospechar que hubo una pérdida en la respuesta terapéutica del paciente o una progresión de su enfermedad.
Entonces me pregunto ¿Cuáles podrían haber sido las causas en nuestro paciente?
Una de las situaciones a plantear existió una falta de adherencia al tratamiento. Existen diversos factores que condicionan la falta de adherencia a los tratamientos, principalmente los crónicos. Algunos de ellos relacionados con el paciente como abandonar la medicación por presentarse asintomáticos, creer que no les va a traer inconvenientes o, como en el caso de nuestro paciente, cambio de marca comercial a presentación genérica.
Existen algunos reportes de casos y trabajos de investigación donde se llegó a la conclusión de que si el paciente respeta la medicación horaria, diaria y a la dosis correspondiente, no debería haber alteraciones en la acción de la misma, independientemente de su presentación comercial.
Como ejemplo, en un trabajo unicéntrico realizado por Riva, a 24 pacientes con diagnóstico de leucemia mieloide crónica se les comenzó tratamiento con dos marcas de imatinib durante un determinado tiempo en el cual se midieron las concentraciones plasmáticas del imatinib, posteriormente se suspendió dicha terapéutica continuando con las formas genéricas durante otro periodo de tiempo. Se pudo concluir que a dosis bioequivalentes no se evidenciaban diferencias.
Existen factores que condicionan la adherencia de los tratamientos relacionados con la medicación, por ese motivo me pregunto si la falta de respuesta a la terapéutica de nuestro paciente puede tratarse de un efecto adverso del imatinib. Si bien es un fármaco bien tolerado en la mayoría de los casos, el uso de este medicamento no está exento de efectos secundarios. Dentro de éstos tenemos algunos NO HEMATOLÓGICOS (nauseas, vómitos, dolor abdominal, mialgias, dolores óseos, cefalea, tos, disnea, edemas y manifestaciones cutáneas) y HEMATOLÓGICOS a los cuales me voy a referir. Si bien se producen con mayor frecuencia dentro de las primeras 4 a 6 semanas de iniciado el tratamiento, se han visto reportes de casos donde se manifestaron tardíamente. Dentro de los segundos se puede producir anemia, leucopenia o plaquetopenia afectando una serie individualmente o con combinación de las mismas; incluso se han reportado casos de aplasia medular. Por este motivo creo que es importante obtener el resultado de la biopsia de medula ósea.
Otra posibilidad es de progresión de su enfermedad es que haya realizado una resistencia al tratamiento y que, por ese motivo, dejó de presentar respuesta terapéutica. Entre las formas de resistencia tenemos aquella primaria que se produce en menos del 10% de los casos y se define como el fracaso para lograr una respuesta hematológica completa a los 3 meses de iniciado el tratamiento o una respuesta citogénica completa a los 12 meses de iniciado el tratamiento. Recordemos que el paciente había logrado una respuesta hematológica completa una vez iniciado el tratamiento, por ello estaríamos frente a una resistencia secundaria, donde se pierde la respuesta obtenida inicialmente. Esta es mucho más frecuente en los casos en que la leucemia mieloide crónica deja de estar en la fase inicial de la enfermedad o fase crónica y evoluciona a una fase acelerada o a una crisis blástica.
Puede nuestro paciente encontrarse en alguna de estas fases de la enfermedad? Lo creo poco probable ya que, si bien en los análisis de sangre periférica presenta anemia y plaquetopenia, deberíamos evidenciar la presencia de leucocitosis asociada a células inmaduras o blastos y no es lo que evidenciamos en el frotis de sangre periférica ni en los análisis de laboratorio de nuestro paciente.
Otra posibilidad es que nuestro paciente haya presentado una mutación del gen BCR/ABL y, que por ese motivo, tenga una falla en la respuesta terapéutica. Si bien existen múltiples mutaciones (más de 70) debido a modificaciones en la cadena de aminoácidos del gen, 15 de éstas representan el 85%. La modificación en el gen va a definir que medicación se debería elegir para continuar con el tratamiento.
Entonces, estamos ante un paciente varón de 44 años con antecedente de leucemia mieloide crónica con mala respuesta terapéutica que actualmente cursa internación por pancitopenia. Una de las principales posibilidades es que nuestro paciente tenga una toxicidad por imatinib, por ese motivo creo que fue adecuada la suspensión del mismo. Será muy importante esperar el resultado de la biopsia de medula ósea donde deberíamos evidenciar hipocelularidad.
No podemos descartar una mutación del gen BCR/ABL, por eso es indispensable esperar el resultado del mismo.
¿Cómo continuar con el tratamiento de nuestro paciente?
El tratamiento correspondiente sería continuar con un inhibidor de la tirosinkinasa de segunda generación ya sea Nilotinib o Dasatinib, únicos disponibles en Argentina. La elección del mismo va a depender de los resultados de la mutación, en el caso de que exista. Además, creo que sería pertinente esperar los resultados de la biopsia y ver si la pacitopenia del paciente resuelve al haber suspendido el imatinib.
BIBLIOGRAFÍA:
-
Severini J., Tardío C., Bellantig Tardío M., Cusumano M, Dolce V., col. Hospital Juan Bautista Alberdi. Rosario. Abordaje del paciente con pancitopenia. Publicación digital de la 1ra Cátedra de Clínica Médica y Terapéutica y la Carrera de Posgrado de especialización en Clínica Médica Facultad de Ciencias Médicas - Universidad Nacional de Rosario. 2010. Disponible en www.clinica-unr.org.
-
Castro Rios M., Heller P., Kornblihtt L., col. Guía diagnostica terapéutica 2010. Sociedad Argentina de Hematología. 2010. 01-39.
-
Avila Cabrera O., González Albelo Y., Espinosa Martínez E., col. Aspectos diagnósticos, evolutivos y terapéuticos de la mielofibrosis primaria. Revista Cubana de Hematología, Inmunología y Hemoterapia. 2011; 27(3):407-17.
-
Pavón Morán V., Hernández Ramírez P., Martínez Antuña G., col. Leucemia mieloide crónica. Actualización en Citogenética y Biología Molecular. Revista Cubana de Hematología e Inmunología. 2005; 21 (2):1571-81.
-
Beligoy L., Bordone J., Conti R., col. Leucemia Mieloide crónica. Guía de diagnóstico y tratamiento. Sociedad Argentina de Hematología. 2008. 205-30
-
Beligoy L., Bengio R., Enrico A., col. Leucemia mieloide crónica. Guía de diagnóstico y tratamiento. Sociedad Argentina de Hematología. 2017. 429-46.
-
Agramonte Llanes O., Pavón Morán V., Hernández Padrón C., col. Aplasia irreversible por el tratamiento con mesilato de Imatinib en una leucemia mieloide crónica. Presentación de un caso. Revista Cubana de Hematología e Inmunología. 2007; 23 (1). Disponible en: www.scielo.sld.cu
-
Riva ME., Manciola F., Gutiérrez R., col. Leucemia mieloide crónica e inhibidores de tirocinquinasa: perfil de toxicidad. Interrupción de tratamiento e impacto en los resultados. Estudio prospectivo en un único centro. Sociedad Argentina de Hematología. 2018; 22 (2). 157-63
-
Pavón Morán V., Hernández Ramírez P., Fagundo JC., col. Imatinib en leucemia mieloide crónica. Revista Cubana de Hematología e Inmunología. 2005; 21 (3). Disponible en: www.scielo.sld.cu
-
Avilés-Vásquez S., Chávez-González A., Mayani H. Inhibidores de cinasas de tirosina (ICT): la nueva revolución en el tratamiento de la leucemia mieloide crónica (LMC). Gaceta médica de México. 2013; 149. 646-54.
-
Bitencourt R., Zalcberg L., Drumond Louro I. Imatinib resistance: a review of alternative inhibitors in chronic myeloid leukemia. Revista brasilera de Hematología. 2011; 33 (6). 470-75.
-
Srinivas U., Pillai L., Kumar R., col. Bone Marrow Aplasia—A Rare Complication of ImatinibTherapy in CML Patients. American Journal of Hematology. 2007; 82. 314–16.
-
Ostojic A., Sertic D., Roncevic P., col. Comparison of Branded and generic imatinib plasma concentrations in patients with chronic myelogenous leukemia: unicentric study. Clin Lymphoma myeloma leuk. 2016: 16 (8). 472-76.
|
Imágenes del caso
|